È una mattina come tante, sono ancora assonnato e il brontolio della caffettiera mi richiama in cucina. Sarà la mia deformazione professionale da insegnante, ma di fronte all’aroma invitante del caffè appena fatto non riesco a fare a meno di pensare a quanta chimica c’è in una colazione. Continuo a sognare per un po’ e immagino che potrei iniziare la giornata facendo lezione proprio qui, trasformando la mia cucina in un laboratorio.
Si inizia con un buon caffè
Come funziona una moka? Se provassimo a chiedere alle persone perché il filtro ha la forma di un imbuto, con il collo che arriva quasi al fondo della caldaia bollitore, non tutti saprebbero rispondere. Quando disponiamo l’acqua nella caldaia, facciamo attenzione a lasciar libero un po’ di spazio affinché sia occupato dall’aria (Figura 1A). Una volta sistemata la moka sul fuoco, l’aria si riscalda, si espande e assieme al vapore prodotto dal riscaldamento dell’acqua incrementa la pressione sull’acqua sottostante. Questa pressione costringe l’acqua calda a risalire il tubo del filtro a imbuto e a fluire attraverso la polvere di caffè contenuta in un secondo filtro (Figura 1B). Dunque, il vapor d’acqua non raggiungere il caffè, ma contribuisce, in un secondo tempo, a esercitare pressione sull’acqua liquida. Il flusso d’acqua (solvente) estrae la caffeina e altri aromi solubili dalla polvere e crea un effetto eluente (lo stesso principio è utilizzato nelle colonne cromatografiche) che trascina particelle insolubili, molto piccole, non trattenute dal filtro. In questo modo, si hanno due metodi di separazione combinati: l’estrazione con solvente associata a una filtrazione.
A questo punto, la bevanda nel bricco di raccolta (Figura 1C) è una soluzione formata da un solvente (l’acqua) e diversi soluti (caffeina, polifenoli, sali minerali ecc.). Tuttavia, a causa delle polveri insolubili, il caffè si comporta anche come colloide e come sospensione.
Il pennacchio bianco che accompagna il brontolio della caffettiera, non è vapore. O meglio, non lo è più: si tratta infatti di minuscole goccioline d’acqua formatesi per condensazione dei vapori prodotti dal caffè caldo della goccia, le forze di attrito (dipendenti dalla superficie) sono maggiori rispetto alla forza peso di ciascuna goccia (dipendente dal volume). Quando questo avviene, si forma una nebbia: un aerosol liquido che costituisce un’altra tipologia di colloide. Per osservare una delle proprietà dei colloidi basterebbe usare un piccolo puntatore laser: facendo passare la luce attraverso il pennacchio bianco, oppure attraverso un po’ di caffè versato in una provetta e diluito con dell’acqua, si osserverà la “strisciata” della luce diffusa attraverso il colloide, il classico effetto Tyndall (Figura 2).
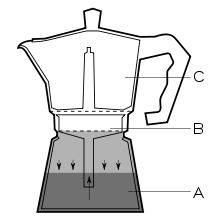
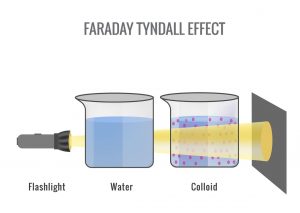
Figura 1: Struttura di una Moka. A) Caldaia con acqua, B) filtro ad imbuto, C) bricco di raccolta
Figura 2: Effetto Tyndall. A sinistra una soluzione vera, a destra un colloide
Il pane non manca mai
In genere, per ottenere una temperatura e una morbidezza perfette, si riscalda la fetta di pane nel microonde. Le microonde sono costituite da un campo elettromagnetico, che inverte la propria polarità circa 2,5 miliardi di volte al secondo. Se incontrano una molecola d’acqua, che è fortemente polare a causa delle differenti elettronegatività di idrogeno e ossigeno, ne inducono la vibrazione per effetto dell’interazione con le sue cariche. La vibrazione delle molecole d’acqua si traduce, a causa dell’attrito, in un aumento di temperatura. L’effetto delle microonde dipende dunque dalla struttura molecolare delle singole sostanze e dal loro contenuto di acqua: è per questo motivo che il piatto di ceramica rimane freddo nonostante il pane sopra sia soffice e caldo, o che ci si scotta le labbra se si scalda il latte in una tazza con il bordo decorato. Nel microonde, infatti, non bisogna mai introdurre metalli (per esempio la stagnola) o vernici contenenti metalli (come quelle di alcune ceramiche) perché le microonde generano correnti elettriche che provocano scariche e surriscaldamenti sul metallo stesso.
Il microonde fu inventato quasi per caso negli anni ‘40 in Inghilterra, da un tecnico che lavorava alla produzione di radar. Questi si accorse che una barretta di cioccolato posata nelle vicinanze del generatore di microonde di un prototipo si era sciolta. Incuriosito, provò a concentrare le microonde su dei chicchi di mais, che si trasformarono in popcorn: l’acqua presente nella polpa del chicco evapora e, trattenuta dalla buccia, crea una sovrapressione che lo fa scoppiare. Anche se non li mangio a colazione, non metterei mai delle castagne con la buccia o dei gamberetti con il guscio dentro al microonde: il botto sarebbe assicurato.
Per riprodurre a scuola un’esperienza simile, basterà riscaldare un becher di vetro contenente acqua e un becher di vetro contenente olio, in quantità uguali; in pochi minuti si osserverà una notevole differenza di temperatura fra i due liquidi. Poi, sarà necessario discutere con gli alunni cosa significhi “quantità uguali” nei due contenitori: stesso volume, stessa massa o stesso numero di moli?
Per una buona colazione c’è sempre anche qualcosa di dolce
Come il miele, che è prodotto con una serie di sistemi di separazione molto comuni nei laboratori di chimica: la centrifugazione associata alla filtrazione (per raccogliere il miele dalle cellette) e la decantazione in imbuto separatore (il bidone maturatore degli apicoltori). Sul tavolo, potrebbero esserci anche la marmellata e le pesche sciroppate, rigorosamente fatte in casa. In questo caso, occorre segnalare una discriminazione: poiché quando tutti pensano a questo tipo di delizie danno molta importanza al barattolo di vetro, è necessario sottolineare che il vero protagonista è il tappo. Durante la preparazione, le pesche sono disposte in un barattolo di vetro, che è tappato e messo a bagnomaria. La tecnica del bagnomaria sfrutta il principio della sosta termica durante l’ebollizione (intorno ai 100 °C), per cui la temperatura interna non aumenta oltre questo valore e l’alimento è sterilizzato a temperatura costante senza bruciacchiarsi. Dentro al barattolo si genera anche una sovrapressione dovuta al vapore che vi si forma e all’aria riscaldata che si espande come previsto dalle leggi dei gas. In questo caso, il tappo, che funziona come una valvola di non ritorno, lascia uscire i gas quando la pressione all’interno è più alta rispetto all’esterno e non permette che ne entrino quando la pressione interna diminuisce a causa del raffreddamento del gas e della condensazione del vapore (Figura 3); si instaura così un ambiente sterile e ipobarico che impedisce la crescita di muffe e batteri (sottovuoto).

Figura 3: vaso per la sterilizzazione e principio di funzionamento
Qualora non si gradisse il caffè, la scelta della bevanda mattutina potrebbe ricadere sul tè, che è ottenuto per estrazione con solvente e filtrazione.
Se si aggiunge lo zucchero, trattandosi di saccarosio (C12H22O11)) in acqua, si ottiene una soluzione non elettrolitica della quale si può ricavare la molarità con pochi e semplici calcoli. Se si preferisce il limone, invece, è possibile osservare una decolorazione istantanea del tè (Figura 4). Ipotizzando che ciò sia dovuto al colore chiaro del succo, si potrebbe verificare la supposizione aggiungendo un altro elemento chiaro come il bicarbonato di sodio: a questo punto, il tè, oltre a diventare imbevibile, cambia di nuovo colore, passando a tonalità più scure. Tale fenomeno è dovuto al fatto che il tè è un indicatore di pH, per cui cambia colore a seconda che l’ambiente sia basico (tè e bicarbonato) o acido (tè e limone).
Il limone è uno dei frutti più utilizzati nei laboratori scolastici: la scorza è ricca di limonene, che può essere estratto con un semplice distillatore in corrente di vapore, mentre il succo è un acido debole; si possono fare esperienze di titolazioni colorimetriche per misurarne sia l’acidità totale (dovuta soprattutto all’acido citrico) sia il contenuto di vitamina C. Inoltre, trafiggendo un limone con due lamine di metalli diversi (es. zinco e rame) è possibile costruire una semplice pila a setto poroso (Figura 5).

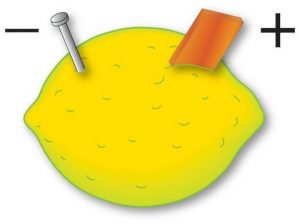
Figura 4: diverse colorazioni del tè in seguito all’aggiunta di una sostanza acida
Figura 5: pila realizzata con limone, lamella di rame (catodo) e un chiodo di ferro (anodo)
E infine i biscotti
Basta intingerli nel tè per osservare il liquido risalire anche nella parte emersa di biscotto in pochi secondi (Figura 6). L’imbibizione è una conseguenza della capillarità, ovvero la capacità di alcuni liquidi (fra i quali l’acqua) di risalire, contro gravità, lungo un tubo molto stretto (capillare) (Figura 7). L’etichetta nutrizionale dei biscotti, inoltre, presenta un esempio di misure utilizzate nelle miscele e nelle soluzioni solide: la percentuale massa su massa (%m/m).


Figura 6, 7: Principio di capillarità e imbibizione da risalita



